- 上海中申國際貿易有限公司,20年外貿進出口代理服務經驗。
- 服務熱線:139 1787 2118
在過去的幾年里,巴西的醫療器械產業不斷發展,已經成為了拉丁美洲最大的醫療器械市場。對于出口商來說,了解巴西醫療器械的準入法規至關重要。本文主要從巴西醫療器械立法機構、醫療器械的分類,以及醫療器械產品的市場準入等方面進行深入剖析。
目錄
Toggle巴西醫療器械立法及主管機構
巴西醫療器械監管的基本法規是RDC185/01。該法規由國家衛生監督局(ANVISA)負責執行。ANVISA是巴西的主要監管機構,負責審批和監督醫療產品的市場準入。
巴西醫療器械的分類
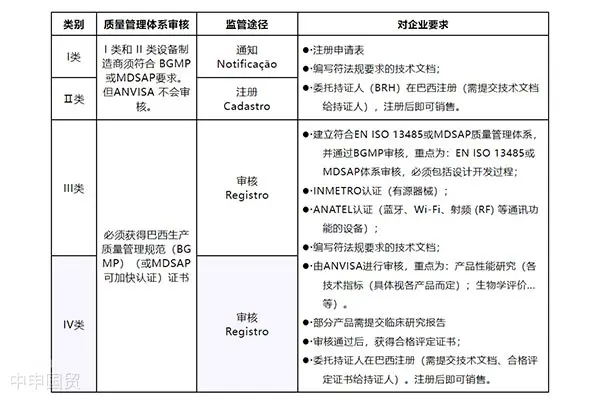
在巴西,醫療器械按照風險等級被分類為四個級別,分別是Ⅰ、Ⅱ、Ⅲ 和Ⅳ類。Ⅰ類代表最低風險,而Ⅳ類代表最高風險。醫療器械的分類規則在RDC185法規的附錄II中有詳細規定。
巴西醫療器械產品的市場準入
巴西對于任何涉及人體的產品(包括藥品、醫療器械、美容化妝品等)的經營都有嚴格的規定。出口商在銷售這些產品前,必須向巴西衛生部提交書面申請,并通過官方指定的注冊持證人提供注冊材料。這些材料必須以葡萄牙語為主要語言。
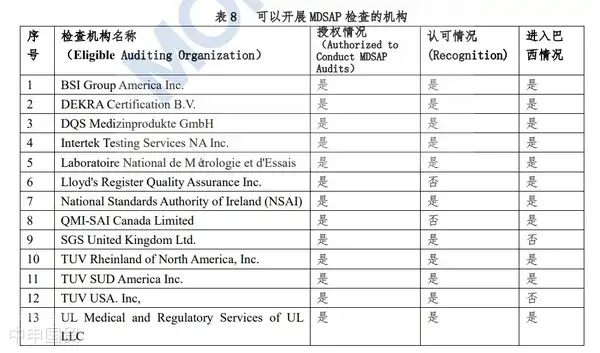
具有動力源的醫療器械產品需要通過認證。認證過程由第三方機構執行,其將對產品進行檢測,并對生產工廠進行審核。對于風險較高的III類和IV類醫療器械,制造商可以選擇使用MDSAP(醫療器械單一審核程序)審核來替代ANVISA的審核。值得注意的是,巴西目前已經公布了11家獲得授權的MDSAP檢測機構。
(1)什么是MDSAP
MDSAP全稱Medical Device Single AuditProgram(醫療器械單一審核程序),是國際醫療器械監管者論壇IMDRF的MDSAP監管機構委員會發起的。MDSAP也就是我們俗稱的五國聯審,是美國(FDA)、澳大利亞(TGA)、巴西(ANVISA)、加拿大(HC)、日本(MHLW)五國的監管機構認可并加入的一套新的審核程序。
(2)ANVISA注冊流程
對于想在巴西市場銷售醫療器械的非本土生產商,需要按照ANVISA的規定進行認證和注冊。基本的步驟和流程包括確定產品類別,指定巴西注冊持有人(BRH),進行INMETRO認證,BGMP驗廠,準備技術文檔,支付申請費用,并最終獲得批準銷售。
(3)巴西出口醫療器械的上市許可所適用的主要法規
在巴西,醫療器械的上市許可需要遵守若干主要法規,這些法規包括醫療器械的準入法規RDC 185/2001和RDC 40/2015,以及臨床試驗法規RDC 10/2015和醫療器械制造商的GMP法規RDC 183/2017。
巴西的醫療器械市場雖然巨大,但是市場準入的法規也相對復雜。對于想在巴西市場銷售產品的出口商來說,理解和遵守這些法規是非常重要的。這不僅可以確保他們的產品能夠合規上市,也有助于減少可能的法律風險和不必要的成本。
相關推薦
聯系我們
郵箱:service@sh-zhongshen.com
相關推薦
微信聯系

? 2025. All Rights Reserved. 滬ICP備2023007705號-2  滬公網安備31011502009912號
滬公網安備31011502009912號